Для цитирования: Бакулин И. Г., Шаликиани Н. В. Алкоголь и изменения микрофлоры кишечника: современные представления // Доктор.Ру. Гастроэнтерология. 2016. № 1 (118). С. 38–42.
15 января 2016
Цель обзора: представить современное видение участия этанола в изменениях кишечной микрофлоры как одного из факторов прогрессирования алкогольного заболевания печени.
Основные положения. Алкоголь способен существенно изменить количественный и качественный состав микрофлоры кишечника. Он приводит к избыточному бактериальному росту в тонкой кишке. Под влиянием ацетальдегида — промежуточного продукта метаболизма этанола — снижается барьерная функция кишечной стенки за счет воздействия на белки плотного и адгезионного контакта.
В повышении кишечной проницаемости играет роль также этанолиндуцированная активация синтеза NO и O 2 — , которые путем нитрирования и окисления тубулина повреждают микротрубочки цитоскелета. Изменения таксономического состава микрофлоры у злоупотребляющих алкоголем заключаются в активном росте грамотрицательных бактерий. Последние являются источником эндотоксинов, которые активируют печеночные макрофаги и приводят к продукции провоспалительных цитокинов — фактора некроза опухоли альфа, интерлейкинов 1 и 6.
Дисбактериоз у взрослых симптомы, лечение
Заключение. Экспериментальные исследования показали, что уменьшение этанолиндуцированной проницаемости кишечника, эндотоксемии и, как следствие, воспаления в печеночной ткани может быть достигнуто с помощью антибиотиков, пре- и пробиотиков. Это открывает возможность использования препаратов, направленных на восстановление кишечного микробиома, для эффективного лечения алкогольной болезни печени.
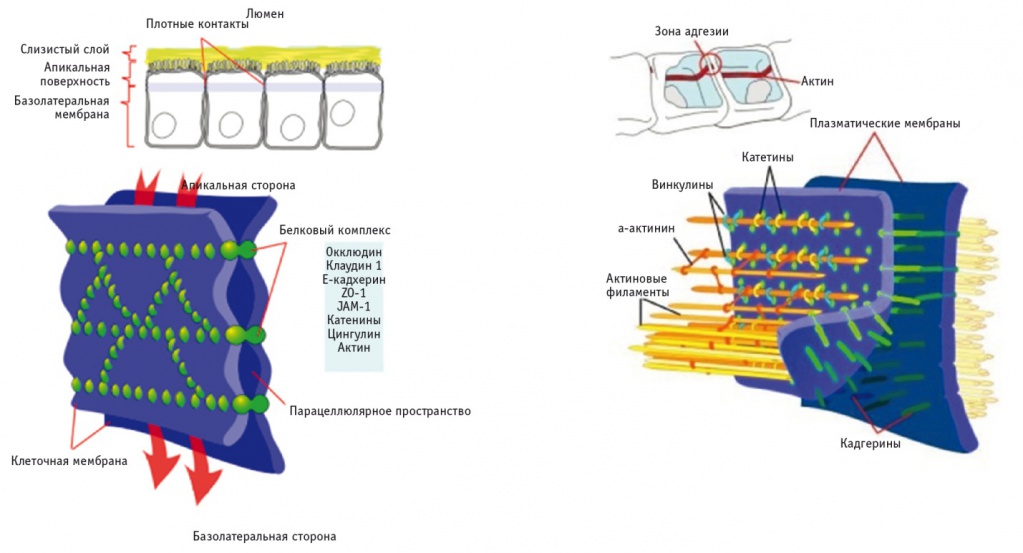
Разрушение плотного и адгезионного контакта ацетальдегидом продемонстрировано на модели Caco-2-клеток (клетки карциномы кишечника Caco-2 морфологически и функционально похожи на барьерный эпителий кишечника и успешно применяются для оценки проницаемости и абсорбции в ЖКТ, а также для изучения активного транспорта веществ) с использованием иммунофлюоресцентной микроскопии. Ацетальдегид вызывает перераспределение окклюдина и zonula occludens 1 ( ZO -1) из межклеточных соединений и диссоциацию этих белков с актином цитоскелета, а также выводит E-кадгерин и β -катенин из межклеточных контактов, тем самым нарушая адгезионный контакт. Ацетальдегидиндуцированное перераспределение белков плотного и адгезионного контакта и отделение их от цитоскелета были выявлены в биоптате толстой кишки человека на фоне приема алкоголя [7]. Проведена оценка мРНК ключевых маркеров целостности ПК, а также белков-адаптеров ПК. Показано, что экспрессия мРНК ZO -1 и клаудина 1 (белки ПК) снижается в ответ на хронический прием этанола [7].
Роль оксида азота в нарушении барьерной функции кишечника Признание роли NO в нарушении барьерной функции кишечника последовало за выявлением повышенной экспрессии синтетазы окиси азота (iNOS) в эпителии воспаленной слизистой оболочки кишечника, ассоциированной с повышенной проницаемостью кишечной стенки. В двух различных исследованиях A. Banan и соавт. продемонстрировали повышение экспрессии iNOS и увеличение продукции NO и О2 — в человеческих Сасо-2-клетках под влиянием этанола (от 2,5% до 15%). Роль NO и О2 — заключается в нитровании и окислении тубулина и в повреждении микротрубочек цитоскелета. При этом нарушение эпителиального барьера определяется путем измерения апикально-базолатерального потока флюоресцентного маркера [4]. Эпидермальный фактор роста может защитить и восстановить функцию кишечника путем стабилизации цитоскелета с помощью подавления активности iNOS [5].
Как избавиться от дисбактериоза без врачей и анализов!
Роль эндотоксемии в развитии алкогольной болезни печени Нарушение проницаемости кишечной стенки приводит к «утечке» бактериальных эндотоксинов. В норме эндотоксины выводятся с калом и только незначительное количество их может проникать через кишечную стенку и попадать в кровоток. По различным данным, уровень эндотоксемии у больных АБП в 5-20 раз выше, чем у здоровых индивидов.
Эндотоксины и эндотоксининдуцированные макрофаги, в свою очередь, повышают проницаемость кишечной стенки, тем самым замыкая порочный круг. Клинические и экспериментальные исследования показали, что эндотоксины, поступившие в кровоток из кишечника, играют важную роль в развитии АБП [8, 10, 11].
Уровень эндотоксемии коррелирует с уровнем противовоспалительных цитокинов и степенью поражения печени [24]. Эндотоксины, наряду с этанолом, приводят к активации как печеночных (клетки Купфера), так и внепеченочных макрофагов и продукции провоспалительных цитокинов, таких как ФНО- α , ИЛ-6, ИЛ-1.
Активация клеток Купфера эндотоксинами происходит посредством двух типов рецепторов — CD14 и TLR4. CD14 — это поверхностный рецептор без цитоплазматического домена, TLR4 — трансмембранный белок с цитоплазматическим доменом, который нековалентно связан с белком MD2. CD14 связывает липополисахариды (ЛПС), далее этот комплекс распознается TLR4.
CD14 имеет растворимую форму, которая облегчает трансфер ЛПС в комплекс TLR4/MD2. Связь между CD14 и ЛПС осуществляется посредством ЛПС-связывающего белка [24].
Распознание ЛПС TLR4-рецепторами на поверхности макрофагов и других клеток печени ведет к включению нисходящих сигнальных путей, отвечающих за активацию транскрипционных факторов, таких как NF-kB и активирующий протеин 1. Этот процесс приводит к увеличению продукции провоспалительных цитокинов: ИФН- γ , ФНО- α , ИЛ-6, ИЛ-1, — хемокинов и активных форм кислорода [24]. Кроме того, активация TLR4 способствует фиброгенезу путем сенсибилизации звездчатых клеток печени. Наряду с эндотоксинами, бактериальная ДНК, пептидо-гликаны и флагелины также попадают в кровоток и играют роль в прогрессировании АБП. Бактериальную ДНК выявляют в плазме крови больных алкогольным циррозом печени [15]. ДНК бактерий распознается TLR9-рецепторами и повышает чувствительность печени к эндотоксининдуцированному поражению.
ПЕРСПЕКТИВЫ ЛЕЧЕНИЯ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ Изучение этанолиндуцированных изменений микрофлоры кишечника приобретает значимость, так это может открыть новые пути лечения АБП. Например, антибактериальная терапия подавляет избыточный бактериальный рост и улучшает прогноз АБП.
Оптимальными лекарственными средствами в этом случае могут быть рифаксимин, пенициллины, метронидазол, пероральные фторхинолоны. По поводу метронидазола данные противоречивы, так как его применение может привести к росту уровня ацетальдегида в просвете толстой кишки за счет подавления анаэробной флоры и увеличения содержания аэробных бактерий с избыточной экспрессией алкогольдегидрогеназы [32].
Под влиянием ципрофлоксацина, напротив, не только подавляется рост кишечной микрофлоры, но и происходит снижение уровня ацетальдегида и активности кишечной алкогольдегидрогеназы [33]. В эксперименте после приема пероральных антибактериальных препаратов широкого спектра действия (полимиксин B и неомицин) и пробиотиков (лактобактерий) не только резко снижался уровень эндотоксинов, но и уменьшалась тяжесть алкогольного поражения печени у крыс [6].
Данные об эффектах про-, пре- и симбиотиков при АБП получены в основном в экспериментальных исследованиях. L. rhamnosus Gorbach — Golding (LGG) является наиболее часто используемым пробиотиком.
Одним из первых исследований, продемонстрировавших благоприятные эффекты приема пробиотиков, была работа A. A. Nanji и соавт., которые показали значительное снижение уровня эндотоксинов и тяжести алкогольного поражения печени у крыс на фоне приема лактобактерий [27]. В другом исследовании с использованием лактобактерий отмечено, что применение LGG значительно уменьшает повреждение ткани печени у крыс с алкогольным стеатогепатитом.
Улучшение достигается за счет подавления миграции бактерий из кишечника и подавления окислительного стресса и воспаления как в кишечнике, так и в печени [17]. В работах E. Mutlu и соавт. показано, что ежедневное потребление алкоголя в течение 10 недель значительно меняет состав кишечной микрофлоры у крыс. Процесс удается предотвратить при одновременном приеме лактобактерий [26].
Пилотное исследование C. Loguercio и соавт., где лактобактерии применялись у пациентов с алкогольным циррозом печени, выявило статистически значимое улучшение печеночных проб в виде снижения уровня АЛТ, а также уменьшения содержания ФНО- α [23]. Escherichia coli (Nissle) восстанавливает баланс кишечной микрофлоры, уменьшает эндотоксемию и улучшает функцию печени [20]. Пробиотики содержащие Bifidobacterii и Lactobacterii , способствуют снижению уровня провоспалительных цитокинов при алкогольном циррозе печени [23]. Похожий положительный эффект показан в другом крупном исследовании, в котором применялись пробиотические препараты, содержащие Bifidobacterium bifidum и L. Plantarum [19]. Показано, что L. casei Shirota оказывают благотворное влияние на восстановление фагоцитарной способности нейтрофилов — маркера, низкий уровень которого ассоциирован с повышенным риском инфицирования и смерти при АБП [31] ( табл. ). Таблица Влияние пробиотиков на течение алкогольного заболевания печени
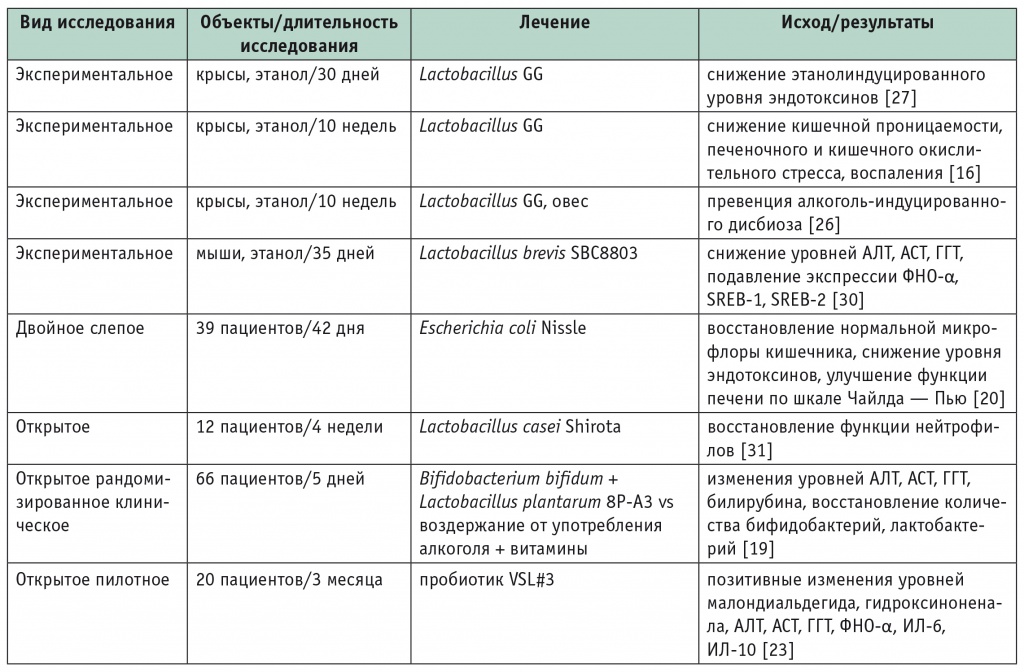
Примечание. АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ГГТ — гамма-глутамилтранспептидаза; ИЛ — интерлейкин; ЛДГ — лактатдегидрогеназа; ФНО — фактор некроза опухоли; SREB — sterol regulatory element-binding protein (белок, связывающий стеролрегулирующие элементы).
J. S. Bajaj и соавт. в рандомизированном контролируемом исследовании показали, что прием кисломолочного продукта с пробиотиками Streptococcus thermophilus, L. bulgaricus, L. acidophilus, Bifidobacteria и L. casei свыше 60 дней может привести к регрессу минимальный печеночной энцефалопатии у пациентов с неалкогольным циррозом печени [3]. При приеме пробиотиков может произойти не только регресс энцефалопатии, но и снижение уровней билирубина, аминотрансфераз и функционального класса цирроза печени по Чайлду — Пью [24]. Таким образом, клинико-экспериментальные данные о применении пре- и пробиотиков позволяют говорить о положительных клинических эффектах использования указанных групп препаратов при АБП, в том числе для регресса алкоголь-индуцированных изменений кишечной микрофлоры. Учитывая изложенное выше, препаратом выбора для коррекции дисбиотических нарушений при АБП можно считать пробиотик Линекс — комплексный препарат со сбалансированным составом полезных живых лиофилизированных бактерий B. infantis, L. acidophilus и Enterococcus faecium . Применение пробиотика Линекс в комплексной терапии у пациентов с хроническими заболеваниями печени приводит к улучшению клинико-лабораторных показателей, иммунологического статуса, качества жизни [1]. Полагаем, что среди пробиотиков еще больший интерес может представлять новый препарат Линекс форте, в состав которого входят молочнокислые бактерии L. acidophilus ( LA -5) и B. animalis subsp. lactis ( BB -12) [25]. Известны механизмы, посредством которых LA -5 и BB -12 подавляют рост патогенных бактерий:
снижение рH в кишечнике ( LA -5 продуцируют молочную кислоту, а ВВ -12 синтезируют молочную, уксусную и янтарную кислоты);
Продемонстрировано благоприятное влияние BB -12 и LА -5 на микрофлору кишечника и местный иммунитет у здоровых лиц и пациентов с заболеваниями ЖКТ разноговозраста [1].
Алкоголь может быть одним из основных факторов, влияющих на состав и функции микрофлоры кишечника. В число биологических эффектов этанола входят развитие синдрома избыточного бактериального роста в тонкой кишке, нарушение барьерной функции кишечника, а также таксономические изменения микрофлоры кишечника, которые заключаются в повышении роста грамотрицательных протеобактерий. Избыточный бактериальный рост в тонкой кишке, в свою очередь, может быть причиной нарушенного всасывания и дефицита нутриентов, а протеобактерии могут стать источником эндотоксинов, которые активируют клетки Купфера, способствуют синтезу провоспалительных цитокинов и воспалению печени, а также стимуляции фиброгенеза.
Экспериментальные и клинические исследования показали, что уменьшение этанолиндуцированной проницаемости кишечника, эндотоксемии и, как следствие, воспаления в печени может быть достигнуто с помощью антибиотиков и пре- и пробиотиков, что открывает возможность использования препаратов, направленных на восстановление кишечного микробиома, для эффективного лечения алкогольной болезни печени.
Источник: journaldoctor.ru
Питание при дисбактериозе. Важные нюансы.
![]()
Дисбактериоз — это изменение привычной микрофлоры организма человека. Данная болезнь проявляется из-за врожденных аномалий желудочно-кишечного тракта, кишечных инфекций, облучения или перенесенной операции. Но все-таки главной причиной появления этого недуга является употребление разных антибиотиков.
Характерными признаками дисбактериоза являются:
- повышенное газообразование,
- слабость,
- плохое переваривание пищи,
- жидкий стул,
- повышенная утомляемость.
- в тяжелых случаях: потеря веса, интоксикация и обезвоживание организма.
Главное составляющее лечение — это правильное питание.
Лечение питанием не имеет в виду, полное ограничение количества порции или соблюдение временных промежутков ее приема. Кушать можно, сколько хочется, и когда захочется. Просто слушайте свой организм, потому что он лучший ваш советчик.
При синегнойном нарушении нужно есть, как можно больше красного сладкого перца и черную смородину.
При стафилококковом — чеснок, землянику, чернику, малину.
При протейном обострении для питания подойдут малина, клюква, чеснок.
При кандиозном — помогут мята, фенхель, брусника, черемша. При гнилостном воспалении, под рукой нужно иметь тмин, бруснику и смородину.
При обострении главными блюдами должны быть: протертые каши, для удобства можно использовать блендер, супы на воде или слабом бульоне, кисели из черники и вишни, сухари, крепкий чай. Постепенно можно добавлять разварную рыбу, паровые котлеты, протертый творог, мясные фрикадельки.
Источник: premium-clinic.ru
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ

Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
#05-06/01 Ключевые слова / keywords: Гастроэнтерология, Gastroenterology
2001-08-23 00:00
138688 прочтений
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм.
При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз.
Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена.
При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
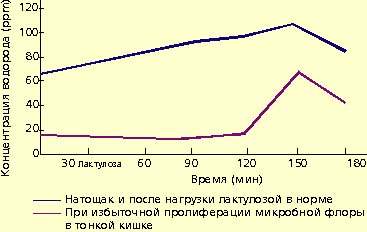 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав.
Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС).
Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
 |
Лечение
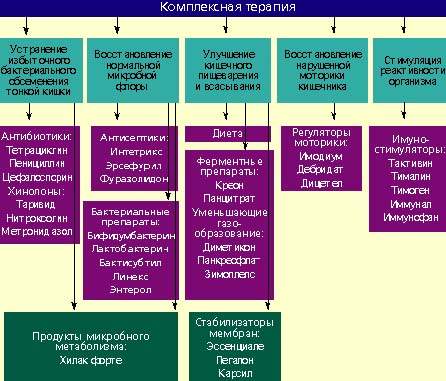
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки.
Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника.
Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Источник: www.lvrach.ru
