Слизистая желудочно-кишечного тракта постоянно подвергается воздействию множества лекарственных препаратов, которые не только лечат, но и повреждают слизистую оболочку, нарушают процессы переваривания пищи в нем. Тема данной статьи — лекарственные поражения желудка — те поражения, причиной которых являются фармакологические средства, и возможной защите слизистой от повреждающих факторов.
Наиболее частые поражения слизистой связаны с приемом нестероидных противовоспалительных препаратов (НПВП), которые являются самыми востребованными в лечении различных сердечно-сосудистых заболеваний и опорно-двигательных нарушениях, для лечения боли и воспаления.
Уникальное сочетание обезболивающего, противовоспалительного и жаропонижаюшего эффектов, удобство использования и доступность определили исключительную популярность этих лекарств.
Применение их увеличивается в связи с постарением населения, особенностями образа жизни человека в современном обществе – питание, малая физическая активность, длительная работа за компьютером и ростом различных сердечно-сосудистых, воспалительных и дистрофических заболеваний костно-мышечной системы, сопровождаемых острой и хронической болью. Но, несмотря на частоту применения, НПВП не являются безопасными лекарственными средствами.
Никотин и мозг: механизм работы ацетилхолина, история никотина ( часть 1 , Вячеслав Дубынин)
Около 70% людей старше 60 лет принимают НПВП не реже 1 раза в неделю. У 30% больных, страдающих ишемической болезнью сердца и принимающих ацетилсалициловую кислоту (аспирин), выявляется поражение желудка. Прием малых «кардиологических» доз аспирина повышает риск развития желудочно-кишечного кровотечения в 1,5 раза и может привести к образованию язв. В клинической практике встречаются проявления побочных проявлений аспирина по России: у каждого третьего пациента определяются диспепсические жалобы (гастропатии), язвенное поражение желудка — у 9%, желудочно-кишечные кровотечения у 1,5% больных. Считается, что нет такой дозы аспирина, которая предотвращала бы тромбообразование в сосудах и не была бы токсичной для желудка.
По данным научного центра сердечно-сосудистой хирургии у 30% пациентов, страдающих ишемической болезнью сердца, определяется поражение желудка, из них эрозии в желудке в 76% и язвы – в 23% случаев. По данным НИИ ревматологии эрозии и язвы определяются в 33% случаев, причем единичные эрозии в 11%, множественные эрозии в 6 %, язвы в 15 % случаев.
Механизм действия НПВП
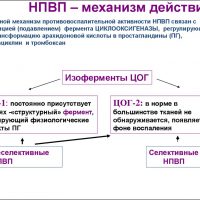
С момента появления первых синтетических НПВП в конце ХIХ века важнейшей проблемой, ограничивающей применение этих лекарств, считается риск развития поражения желудочно-кишечного тракта. Развитие этих осложнений хорошо известно и связано с основным механизмом действия НПВП.
Главной фармакологической «мишенью» действия НПВП является фермент ЦОГ-2, который активно образуется в области поражения тканей органов и повышает концентрацию простагландинов, которые определяют боль и воспаление. Использование НПВП приводит к снижению выработки простагландинов в организме пациента и возникновению трех положительных эффектов – жаропонижающего, противовоспалительного, обезболивающего, а аспирин, снижая концентрацию тромбоксана в тромбоцитах, кроме перечисленных эффектов оказывает выраженное антиагрегантное (противосвертывающее) действие.
Резкий отказ от курения: последствия ► Почему нельзя внезапно бросать курить?
Однако в организме человека присутствует другой фермент, очень похожий на ЦОГ-2, но имеющий совершенно иное предназначение — ЦОГ-1. Этот фермент постоянно работает. И хотя он также образует простагландины, физиологический эффект при этом совсем другой. При отсутствии повреждения простагландины являются важными регуляторами функций организма, «тканевыми гормонами», отвечающими, в частности, за поддержание устойчивости слизистой оболочки желудочно-кишечного тракта к повреждающему действию внешних факторов агрессии.
К сожалению, НПВП не различают эти ферменты и блокируют оба. Тем самым, оказывая обезболивающее и противовоспалительное действие, эти препараты снижают защиту слизистой оболочки.
Снижение простагландинов (ЦОГ-1) отрицательно воздействует на слизистую желудка, приводя к снижению кровотока, уменьшению выработки защитной слизи и ощелачивающих веществ (бикарбонатов), повышению секреции соляной кислоты и ферментов, изменению моторики гастродуоденальной зоны (желудка и 12-перстной кишки).
Лекарственные поражения желудка, 12-перстной кишки
Сначала немного физиологии. Следует напомнить, что в желудке, 12-перстной кишке существует равновесие между «агрессивными» и «защитными» факторами, получившие название «весы Шея». У здоровых лиц защитные факторы всегда преобладают над агрессивными, повреждающими факторами, что обеспечивает сохранение структуры слизистых оболочек желудочно-кишечного тракта при меняющихся условиях среды под воздействием внешних и внутренних факторов.
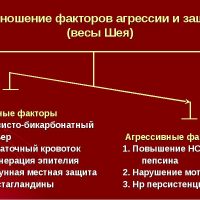
В роли агрессивных факторов выступают следующие:
- соляная кислота желудка,
- фермент пепсин,
- повышенное кислотообразование,
- быстрая эвакуация кислого содержимого в 12-перстную кишку, сопровождающаяся «кислотным ударом» по слизистой тонкой кишки,
- забросы кислоты или желчи в пищевод, желудок,
- лекарственные препараты.
В 60-е годы прошлого столетия было введено понятие «защитный слизевый барьер желудка» — первая линия защиты от агрессивных факторов. К защитным факторам относятся:
- слизь,
- секреция щелочного бикарбоната,
- мембрана эпителиальных клеток,
- состояние кровотока (микроциркуляция),
- обменные процессы,
- синтез простагландинов и окиси азота.
Действие защитных факторов
Слизь – барьер, который защищает лежащие под ней клетки слизистой. Непроницаемая мембрана эпителиальных клеток, покрывающая желудок, предотвращает обратное поступление кислого желудочного сока из просвета желудка.
Следующую линию защиты слизистой создает микроциркуляторное русло крови, которое обеспечивает эпителиальные клетки слизистой желудочно-кишечного тракта водой, кислородом, питательными веществами.
Трофические процессы в слизистой определяют интенсивность восстановительных (репаративных) процессов в слизистой желудочно-кишечного тракта.
Далее — простагландины, которые стимулируют и содействуют функции почти всех механизмов защиты слизистой желудка и кишечника.
Остановимся более подробно на роли простагландинов и окиси азота, которые относятся к основным факторам защиты слизистой оболочки желудочно-кишечного тракта, подвергающейся воздействию различных повреждающих лекарственных средств. Непрерывное образование простагландинов клетками слизистой оболочки желудка является необходимым условием для обеспечения целостности и защиты слизистой против повреждающих факторов.
Простагландины — биологические вещества, улучшающие кровоток в слизистой оболочке и регулирующие моторику желудочно-кишечного тракта, снижающие секрецию желудочного сока в желудке, но стимулирующие секрецию ферментов в поджелудочной железе. ПГ повышают образование защитной слизи и секреции бикарбонатов, обеспечивая устойчивость клеток слизистой к повреждающим факторам, снижают высвобождение воспалительных факторов.
Окись азота (NO) является вторым важным компонентом защиты слизистой оболочки желудочно-кишечного тракта от повреждений посредствам увеличения слизеобразования, секреции щелочных бикарбонатов, кровотока.
Таким образом, ПГ и NO играют важнейшую роль в сохранении целостности слизистой и совместно участвуют в ее защите от различных повреждающих факторов (нестероидные противовоспалительные препараты (НПВП), аспирин, парацетамол, желчные кислоты, пероральные антибиотики, препараты калия и железа, теофиллин, препараты наперстянки, алкоголь).
Токсическое действие НПВП
Имеет место и местный токсический эффект НПВП в течение самых первых дней приема препарата. Большинство НПВП являются слабыми кислотами и могут оказывать прямое раздражающее действие на слизистую оболочку желудка и двенадцатиперстной кишки. Под действием НПВП снижается чувствительность слизистой, препарат проникает через мембрану в клетки слизистой оболочки, накапливается там и вызывает ее повреждение, снижается чувствительность болевых рецепторов и возникает болевой и диспепсический синдромы. Прием НПВП после еды с достаточным количеством воды, особенно при использовании капсульных форм, значительно снижает вероятность контактного раздражающего действия этих лекарств.
Исследования показали, что практически в 100% случаев прием НПВП приводит к развитию острого гастрита через неделю после начала лечения, а регулярный прием НПВП связан с возникновением эрозивно-язвенных поражений слизистой желудочно-кишечного тракта (ЖКТ). Лидером среди органов пищеварения является желудок, поражение которого встречается в 6 раз чаще, чем поражение других органов.
Факторы риска лекарственных поражений желудочно-кишечного тракта
- Язвенная болезнь в анамнезе в семье или у больного, повышенная желудочная секреция желудка.
- Возраст старше 65 лет, чаще женский пол, что может быть связано с увеличенным, но не всегда оправданным употреблением НПВП при головной боли.
- Сочетанное применение НПВП и препаратов, действующих на свертывающую систему крови (антикоагулянты) или НПВП и гормональные препараты (глюкокортикоиды).
- Высокие дозы НПВП или сочетание нескольких НПВП, включая низкие дозы аспирина и продолжительность приема, высок риск в первую неделю и месяц приема препарата,
- Инфекция хеликобактер пилори. На сегодняшний день считается, что хеликобактер и НПВП являются независимыми, но значительно усиливающими друг друга факторами риска язвообразования. Перед приемом НПВП необходимо исключить хеликобактериоз желудка. Наличие хеликобактерной инфекции в 1,5 раза повышает риск поражения слизистой оболочки желудка. Применение НПВП и аспирина повышает риск образования язв в желудке и 12-перстной кишке у лиц, инфицированных H.pylori, повышает риск развития язвенного кровотечения и увеличивает его более чем в 6 раз.
- Сочетание заболеваний сердечно-сосудистой системы и ревматических болезней.
- Особенно высока частота тяжелых осложнений со стороны желудка, достигающая 9%, в течение 6 месяцев приема препарата у пациентов с несколькими факторами риска.
- Поскольку риск желудочно-кишечных кровотечений прямо пропорционален дозе препарата, то для профилактики сердечно-сосудистых осложнений используются минимально достаточные дозы аспирина. При этом установлено, что прием даже 10 мг /сутки при длительном приеме может вызвать образование язвы в желудке. Считается, что нет такой дозы аспирина, которая бы давала антитромботический эффект и не была бы токсична для слизистой оболочки желудка. По данным опроса пациентов, принимающих аспирин, в России кровотечение развивалось в 1,5% случаев, образование язв в 9%, диспепсические жалобы имел примерно каждый третий пациент.
НПВП-гастропатия и язвенная болезнь
В 1986 году был предложен термин «НПВП-гастропатия», чтобы отличить поражение слизистой оболочки желудка, возникшее при длительном употреблении НПВП, от классической язвенной болезни желудка и 12-перстной кишки.
В отличие от язвенной болезни, НПВП-гастропатия чаще поражает желудок, а не 12-перстную кишку, чаще возникает у пожилых, чем у молодых людей. Кроме того, поражение НПВП препаратами может вызывать серьезные, подчас смертельные осложнения со стороны слизистой оболочки желудка – перфорации язв (разрывы язвы) и кровотечения.
Исследования последних лет показали, что эрозивно — язвенные поражения желудка и 12-перстной кишки отмечаются по разным данным у 20-40% пациентов, регулярно принимающих НПВП. Осложнения НПВП-гастропатии (кровотечения, перфорации язв и их сочетание) по данным американским исследователей составляет 70 000 случаев в год, причем примерно каждый десятый с развившимися осложнениями погибает. Даже прием небольших профилактических доз аспирина (при ишемической болезни сердца) значительно увеличивает число язвенных кровотечений. Так, в Великобритании они составляют около 3500 случаев в год.
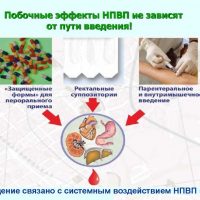
Многочисленные исследования доказали отсутствие существенных различий токсического действия на клетки слизистой оболочки желудка,12-перстной кишки и кишечника. Неважно, каким способом препарат поступил в организм человека – через рот, внутримышечно или в виде свечей через прямую кишку. Основное ульцерогенное действие НПВП определяется их системным воздействием, проявляющимся после всасывания в кровь.
Особенности клинических проявлений лекарственного поражения желудка
Перед приемом НПВП особенно длительного приема целесообразно пройти обследование:
- определить кислотности желудочного сока,
- сделать ЭГДС,
- исключить инфицированность хеликобактерной инфекцией,
- изучить анамнез,
- проанализировать возможные факторы риска поражения желудка, а также сердечно-сосудистой системы (при применении современных селективных средств НПВП).
Следует обратить внимание на особенности клинических проявлений лекарственного поражения слизистой желудка. В большинстве случаев у пациентов отсутствуют какие-либо жалобы, в тоже время у 40% возникают диспепсические проявления – тяжесть в подложечной области, изжога, отрыжка, тошнота, вздутие живота. Эти клинические проявления не являются характерными для лекарственного поражения и не могут рассматриваться как надежные критерии эрозивно-язвенного поражения слизистой оболочки. Тем более, что эти проявления не совпадают со степенью поражения желудка по данным эндоскопического исследования.
При гастродуоденоскопии выявляются изменения слизистой желудка разной степени тяжести от отечности и покраснения до формирования кровоизлияний (петехий), эрозий и язв, которые обнаруживаются у 30-50% пациентов. У ряда пациентов имеется клинический набор всех диспепсических нарушений, а при ГДС выявляются минимальные изменения слизистой оболочки. Напротив, при бессимптомном течении лекарственного поражения при ГДС выявляются множественные эрозии и язвы желудка и луковицы 12-перстной кишки, возникает риск развития осложнений (кровотечение).
Таким образом, по данным ГДС 40% людей, получающих НПВП, с эрозивно-язвенными поражениями верхних отделов ЖКТ не предъявляют жалоб со стороны желудка и, наоборот, до 50% пациентов с диспепсическими жалобами имеют нормальную слизистую оболочку без признаков местного воспаления и морфологических критериев гастрита.
Современные НПВП
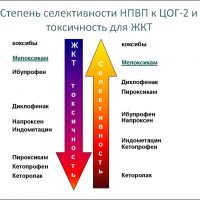
В зависимости от угнетения ферментов, образующих простагландины, различают селективный НПВП — ингибитор ЦОГ-1 — низкие дозы аспирина, неселективный ингибитор, угнетающий ЦОГ-1 и ЦОГ-2, наиболее часто применяемыми препаратами являются – диклофенак (вольтарен), индометацин, ибупрофен, кетопрофен и др. и селективные НПВП по отношению к ферменту ЦОГ-2 , синтезирующему простагландины – целекоксиб, рофекоксиб и др. Развитие побочных эффектов НПВП связано с одновременным угнетением физиологического фермента ЦОГ-1.
Растет популярность препаратов НПВП в связи с ростом заболеваний, сопровождающихся болью, необходимостью длительного или постоянного приема препаратов и их безрецептурным отпуском в аптеках. Важно знать факторы риска побочных действий НПВП при их назначении.
Поделиться:
Источник: bredihina.ru
Влияние пищи, алкоголя, курения на развития язвы желудка и двенадцатиперстной кишки
Слизистая оболочка желудка и двенадцатиперстной кишки первоначально контактирует с принимаемой человеком пищей, и в зависимости от физического и химического состояния пища может по-разному действовать на слизистую оболочку.
Несмотря на то что алиментарный фактор в развитии гастродуоденальных язв не только не является определяющим, но и не доказан, острая, грубая, горячая или холодная пища может способствовать язвообразованию.
Реализация ее патогенного действия может служить причиной хронического гастрита, который расценивается как фактор, предрасполагающий к язвообразованию.
Излишне острая, грубая, особенно поступающая в избыточном объеме, пища способна стимулировать деятельность желудочных желез и увеличивать секрецию желудочного сока.
Нерегулярное питание также создает предпосылки для голодной гиперсекреции и кислотно-пептического повреждения слизистой оболочки.
С другой стороны, некоторые компоненты пищи (молоко, мясо) обладают выраженными протективными свойствами: желудочный сок оказывается заблокированным буферными свойствами этих продуктов.
К числу агрессивных факторов, повышающих вероятность развития язвы, принято причислять травмирующее действие на слизистую оболочку химических, термических и механических свойств пищи.
Не доказана и роль алкоголя в образовании гастродуоденальных язв. В то же время известно, что большие концентрации алкоголя оказывают ингибирующее действие на секрецию соляной кислоты и пепсина, а слабые — стимулирующее.
Доказано также, что алкоголь нарушает защитный барьер слизистой оболочки желудка, что в свою очередь является фактором, предрасполагающим к язвообразованию. Алкоголь к тому же отрицательно влияет на течение уже имеющейся язвенной болезни, т.е. способен провоцировать обострение.
Установлено, что у курящих язвы гастродуоденальной зоны встречаются в 2 раза чаще, чем у некурящих.
Никотин, как известно, вызывает сужение сосудов желудка, ведущее к ишемии слизистой оболочки, усиливает секрецию соляной кислоты, повышает концентрацию пепсиногена I, а также создает условия для гастродуоденально-го рефлюкса.
Кроме того, никотин ингибирует образование желудочной слизи и простагландинов, а также снижает секрецию бикарбонатов поджелудочной железы.
И в то же время все изложенное свидетельствует, что все перечисленные факторы не являются определяющими — им отводится только вспомогательная роль.
М. Козырев, И. Марковская
«Влияние пищи, алкоголя, курения на развития язвы желудка и двенадцатиперстной кишки» — статья из раздела Гастроэнтерология
Источник: www.medgorizont.ru
Табакокурение и гастроэзофагеальная рефлюксная болезнь: патогенетические аспекты
Развитие гастроэзофагеальной рефлюксной болезни (ГЭРБ) в основном ассоциируется [1] с интенсивным воздействием соляной кислоты, в меньшей степени – с воздействием желчных кислот и панкреатических протеаз (прежде всего трипсина) на слизистую оболочку пищевода, в качестве содержимого желудочно-пищеводного рефлюкса (ЖПР), патологически воздействующего на слизистую оболочку пищевода. Увеличение времени длительности клиренса (опорожнения) пищевода увеличивает и вероятность повреждения слизистой оболочки пищевода.
Среди возможных факторов, патологически воздействующих на слизистую оболочку пищевода, очевидно, определенную роль играет и табакокурение.
Однако роль табакокурения в патогенезе ГЭРБ полностью еще не совсем ясна. Тем не менее многое уже известно, что позволяет более уверенно говорить о возможном патологическом воздействии табака на развитие ГЭРБ. По данным суточной рН-метрии, курение табака увеличивает время воздействия кислоты на слизистую оболочку пищевода и соответственно — уменьшает давление нижнего сфинктера пищевода (НСП), создавая предпосылки к возникновению ЖПР; к тому же табакокурение вызывает повышение числа ЖПР, способствующих повышению релаксации НСП.
Образование ЖПР в определенной степени связано [1, 2] с глубоким «вдыханием» воздуха и кашля, появляющегося у части больных. Кислота желудочного содержимого, поступившая в пищевод, частично нейтрализуется выделяемой слюной и, собственно, благодаря перистальтике пищевода смещается в желудок. Табакокурение, с одной стороны, увеличивает время нахождения желудочного содержимого в пищеводе, с другой стороны, уменьшает объем слюноотделения, т.е. оказывает двойное отрицательное действие. По-видимому, влияние табакокурения на организм человека осуществляется в основном посредством действия никотина; подкожно введенный никотин оказывает подобное табакокурению действие на давление НСП и выделение слюны.
Прекращение табакокурения различных табачных изделий, как показывают собственные наблюдения, не приводит к полному выздоровлению больных от ГЭРБ, но все же оказывает некоторое положительное действие на уменьшение частоты и интенсивности изжоги (жжения) за грудиной и/или в эпигастральной области. Лишь у части больных пожилого и старческого возраста, которых ранее беспокоили умеренные по интенсивности изжога и/или боли за грудиной (при отсутствии таких проявлений ГЭРБ, как пептическая язва или стриктура пищевода, а также пищевод Барретта), полное прекращение табакокурения через 2–3 мес часто приводит к полному или почти полному исчезновению этих симптомов. По-видимому, это связано как с возможным уменьшением частоты и выраженности ЖПР, так и со снижением кислотообразования и/или с пониженной чувствительностью пищевода к механическому и химическому воздействию содержимого ЖПР на слизистую оболочку пищевода у больных пожилого и старческого возраста.
Влияние табакокурения и кислоты на состояние пищевода ЖПР
По данным рН-метрии пищевода, ЖПР отмечается чаще у больных, увлекающихся курением табака, чем у здоровых лиц, однако при pH
Число случаев ЖПР в начале курения табака обычно меньше, чем по мере табакокурения. Высокий уровень никотина в крови, по данным исследования фармакокинетики никотина, может определяться в крови более 8 часов после последней выкуренной человеком сигареты, что в определенной степени свидетельствует о длительности действия табакокурения на организм человека.
Однако остается неясным, является ли ЖПР результатом табакокурения, высокого уровня никотина в крови и/или связано с одновременным воздействием этих факторов на организм человека? Можно предположить, что никотин увеличивает время экспозиции кислоты посредством механизма, чаще всего не связанного с актом табакокурения. Увеличение частоты и выраженности изжоги связано [1] с увеличением экспозиции кислоты в пищеводе, ассоциируемой с выраженностью табакокурения. Очевидно, этот эффект связан с фармакологическими особенностями действия никотина не только в период табакокурения, но и непосредственно сразу после него: в определенной степени об этом свидетельствует увеличение числа ЖПР.
Физиологические механизмы действия табакокурения, влияющие на развитие ГЭРБ
Целостность слизистой оболочки желудка поддеживается балансом различных агрессивных и защитных факторов. Табакокурение вызывает ряд изменений в этом балансе. Существенные агрессивные факторы [3] – соляная кислота, пепсин, эндотелин, фактор, активирующий тромбоциты и свободные радикалы. Существенные защитные факторы [4] – простагландины, слизь, дуоденальные и панкреатические бикарбонаты, кровоток в слизистой оболочке и окись азота.
Выраженность течения ГЭРБ зависит от времени экспозиции кислоты в пищеводе, которое в свою очередь зависит от выраженности антирефлюксного барьера и клиренса кислоты пищевода. Табакокурение способствует развитию ГЭРБ за счет снижения давления НСП, удлинения времени клиренса кислоты в пищеводе и транзиторного ослабления НСП, нарушение работы которого способствует развитию частоты и выраженности ЖПР.
Влияние табакокурения на базальное давление НСП
Согласно одной из гипотез, табакокурение снижает выраженность остроты давления НСП на 37% у здоровых лиц во время табакокурения и на 41% – у больных ГЭРБ. Табакокурение оказывает хроническое влияние на базальное давление НСП, а не ограничивается лишь острым влиянием процесса табакокурения на состояние людей. Вероятно, никотин вызывает релаксацию циркулярной мышцы НСП.
Влияние табакокурения на транзиторную релаксацию НСП
Транзиторная релаксация этого сфинктера является основным механизмом возникновения кислотного рефлюкса у здоровых лиц и больных ГЭРБ. Транзиторные релаксации НСП являются проявлением ваговагусного рефлекса, возникающего при растяжении желудка. При отсутствии актов глотания для них характерна релаксация НСП в течение 5 с до 2 мм желудочного давления. Транзиторные релаксации НСП у курильщиков табака наблюдаются с частотой примерно 4 релаксации, транзиторные релаксации НСП не являются доминирующим механизмом, посредством которого табакокурение влияет на ЖПР. Доминирующий механизм, очевидно, связан с внезапным повышением внутриабдоминального давления в период гипотензии НСП.
Клиренс кислоты представляет собой двухступенчатый процесс, суть которого заключается в следующем: вначале с помощью одного или двух перистальтических мышечных сокращений происходит опорожнение пищевода от заброшенной в него рефлюксной жидкости, затем – нейтрализация резидуальной кислоты слюной. Табакокурение пролонгирует клиренс кислоты посредством уменьшения саливации. Вполне возможно, что изменение функции НСП и саливации частично связано и с этим фактом.
Влияние табакокурения на клиренс кислоты
Пролонгирование клиренса кислоты, оказавшейся в пищеводе, обнаруживается почти у 50% больных ГЭРБ в стадии рефлюкс-эзофагита. Очищение пищевода от кислоты, поступившей в пищевод, происходит благодаря клиренсу пищевода.
Вначале посредством одного или двух перистальтических сокращений пищевода происходит уменьшение объема кислоты внутри пищевода до малого резидуального количества. На втором этапе происходит нейтрализация резидуальной кислоты буферным действием слюны. Таким образом, дисфункция и/или уменьшение объема образования слюны пролонгирует клиренс кислоты. Предрасполагающим фактором является уменьшение продукции слюны.
В период табакокурения не отмечается какого-либо изменения в состоянии функции слюноотделения. Возможно, это происходит за счет вторичного эффекта, обусловленного манипуляциями во рту сигаретой при курении табака, – модулирующее влияние на саливацию. Однако сразу же после окончания табакокурения происходит небольшое снижение выброса слюны. При этом у курильщиков табака имеется значительно более низкая секреция саливации, однако отсутствует существенная разница в выраженности перистальтики как у курильщиков табака, так и у не курящих табак лиц.
Значительное увеличение секреции бикарбоната слюны при прекращении курения табака свидетельствует об удлинении времени клиренса кислоты, что, вероятно, является следствием уменьшения саливации.
Влияние табакокурения на опорожнение желудка
Опорожнение желудка замедлено почти у 50% больных ГЭРБ. Нарушение опорожнения желудка – фактор, способствующий прогрессированию ГЭРБ за счет увеличения градиента желудочно-пищеводного давления, что в свою очередь способствует развитию ЖПР и/или увеличению частоты транзиторных релаксаций НПС в результате растяжения желудка.
Рассматривая возможные факторы защиты, необходимо выделить следующие:
1) слизистая оболочка пищевода с многослойным плоским эпителием, который нередко достаточно устойчив к длительному воздействию желудочного содержимого и не подвергается патологическим изменениям, связываемым с воздействием ЖПР;
2) нормальное состояние НПС;
3) нормальная моторика пищевода и желудка;
4) своевременное и достаточное слюноотделение и пищеводный клиренс являются важными компонентами защитного механизма слизистой оболочки пищевода, в определенной степени уменьшающими вероятность развития рефлюкс-эзофагита.
Лечение больных
Еще 4 февраля 2005 г. на V съезде Научного общества гастроэнтерологов России были приняты Стандарты диагностики и терапии кислотозависимых заболеваний, в том числе и ассоциированных с Helicobacter pylori (3-е московское соглашение), в которых ингибиторы протонного насоса были рекомендованы к использованию в терапии кислотозависимых заболеваний. Одним из оригинальных препаратов, отвечающих современным требованиям, предъявляемым к ингибиторам протонного насоса, тогда же был признан пантопразол – производное замещенного бензимидазола, основные показатели фармакокинетики которого: биодоступность – 77%, связывание с белками плазмы на 98%, максимальная концентрация в плазме – через 2–4 ч, метаболизм – система цитохрома Р450.
Значительное достоинство пантопразола (Контролока) – большая стабильность при низких значениях рН, близких к нейтральным (по сравнению с омепразолом и лансопразолом); другое существенное отличие от этих препаратов в том, что структура радикалов находится на пиридиновом и бензимидазольном кольцах.
Наряду с отмеченными выше достоинствами Контролока (пантопразола) значительными его достоинствами являются следующие: этот препарат, оказывая эффективное антисекреторное действие, посредством ингибирования кислотообразования в париетальных клетках слизистой оболочки желудка, обладает и наименьшим потенциалом взаимодействия с другими препаратами, влияя на уровень базальной и стимулированной секреции соляной кислоты. Контролок наиболее эффективно ингибирует кислотообразование в желудке при рН>3 уже в течение первых 18 ч; Контролок хорошо адсорбируется, абсолютная биодоступность составляет около 77%, связывается с белками плазмы на 98%, максимальная концентрация в плазме отмечается через 3 ч. Пантопразол стабилен при низких значениях рН, близких к нейтральным из-за особенностей в структуре его радикалов на пиридиновом и бензимидазольном кольцах, что позволяет рассчитывать прогнозируемые фармакокинетические свойства.
Основные рекомендации по лечению больных ГЭРБ
Независимо от стадии течения ГЭРБ, целесообразно начинать лечение Контролоком в стандартных дозировках (в зависимости от состояния больных 1–2 раза в сутки).
— При наличии у больных, кроме основных, значительно беспокоящих больных симптомов, и симптомов, ассоциируемых с нарушением моторики и/или с гиперчувствительностью желудка к растяжению, а также при наличии выраженных внепищеводных симптомов целесообразно дополнительно в первые дни лечения больных использовать прокинетики (домперидон или метоклопрамид по 10 мг 3–4 раза в день за 15 мин до приема пищи).
— Целесообразно повышение качества жизни больных и соблюдение диетического питания, обычно рекомендуемого больным ГЭРБ.
Варианты ведения больных ГЭРБ после стойкого устранения симптомов и эзофагита
1. При быстром положительном эффекте – динамическое наблюдение (вопрос о дальнейшей тактике решается только при ухудшении состояния больных).
2. «Поддерживающая» терапия (для закрепления результатов в терапии) – Контролок по 40 мг утром за 30 мин до завтрака в течение 2 мес.
3. Терапия «по требованию» применяется при редких случаях появления изжоги и/или боли – один из антацидных препаратов, при более частом (более 2 раз в неделю) – Контролок в терапевтических дозах 1 раз в день.
4. «Периодическая курсовая терапия» Контролоком в терапевтических дозах при рецидивах ГЭРБ, продолжительность которой зависит от наличия/отсутствия симптомов ГЭРБ и эзофагита по данным эндоскопии.
5. При недостаточном эффекте проводится дифференцированный отбор среди больных, нуждающихся в проведении постоянной лекарственной терапии, в том числе и для проведения эндоскопической или «открытой» фундопликации по Ниссену.
Примечание: проведение эрадикационной терапии H. pylori показано лишь тем больным ГЭРБ, у которых имеется хронический гастрит, ассоциированный с H. pylori, и которым не менее чем в течение 1 года была проведена постоянная антисекреторная терапия.
Длительность медикаментозного лечения больных ГЭРБ в период обострения (предполагается условно) – 4–8 нед, при необходимости лечение должно быть продолжено. Всем больным рекомендуется полностью прекратить табакокурение и улучшить качество и образ жизни. Основные критерии окончания сроков лечения больных ГЭРБ – сроки исчезновения симптомов и эндоскопических признаков эзофагита (в том числе, с заживлением эрозий и язв).
Заключение
Табакокурение – один из этиопатогенетических факторов риска развития ГЭРБ, воздействие которого приводит к различным патологическим изменениям в организме человека, в том числе и к увеличению времени повреждающего действия кислоты на слизистую оболочку пищевода: количество желудочно-пищеводных рефлюксов у курильщиков табака значительно больше по сравнению с некурящими лицами, а снижение давления в области НСП до
Прекращение табакокурения не избавляет человека от ГЭРБ, но позволяет улучшить общее состояние больных, в том числе и в период проведения адекватного лекарственного лечения, а также уменьшить вероятность появления рецидива ГЭРБ при соблюдении больными полученных рекомендаций по улучшению образа и качества жизни, а также и рационального питания [4], рекомендуемого больным ГЭРБ.
Литература
Васильев Ю.В. Гастроэзофагеальная рефлюксная болезнь. Избранные главы клинической гастроэнтерологии/ Под ред. Л.Б.Лазебника. — М.: «Анахарис», 2005. -С. 7–27, 414.
Васильев Ю.В. Табакокурение как возможный фактор развития хронического панкреатита и рака поджелудочной железы. Эксперим. и клин. гастроэнтерология.- 2007; 6: 78–81.
Grimes DS, Goddard J. Effect of cigarette smoking on gastric emptying. -BMJ 1978; p. ii:460–1.
Васильев Ю.В. Язвенная болезнь, Helicobacter pylori и табакокурение: патогенетические аспекты и лечение больных. Эксперим. и клин. гастроэнтерология. — 2008; 8: 12–8.
Hanson B. et al. Gastric emptying in smokers. Scand J Gastroenterol 1987; 22: 1102–4.
Gritz ER, Ippoliti A, Jarvik ME et al. The effect of nicotine on the delay of gastric emptying. Aliment Pharmacol Ther 1988; 2:173–8.
Palmer KR, Smith B, Ferrington C, Merrick MV. Smoking delays gastric emptying of solids. Gut 1989; 30: 50–3.
Васильев Ю.В. Диета и образ жизни больных гастроэзофагеальной рефлюксной болезнью. — Cons. Med., 2010; 2: 4–6.
Источник: www.rlsnet.ru
