Алкоголи представляют собой углеводороды, содержащие один или несколько гидроксилов. По их количеству алкоголи могут быть одно- , двух-, трехатомными и т. д., а в зависимости от положения гидроксила — первичными, вторичными, третичными.
Угнетающее действие алкоголей на ЦНС определяется их химической структурой. Оно более выражено у одноатомных спиртов.
Алкоголи, имеющие непредельные связи или содержащие в своей молекуле галогены, обладают сильным не только наркотическим , но и токсическим действием.
Спирт этиловый (этанол, винный спирт)
По фармакологическим свойствам спирт этиловый относится к наркотическим веществам. Наиболее чувствительны к нему клетки ЦНС, особенно клетки коры головного мозга, воздействуя на которые, он вызывает характерное алкогольное возбуждение, связанное с ослаблением процессов торможения. Затем наступает также ослабление процессов возбуждения в коре, угнетение спинного и продолговатого мозга с подавлением деятельности дыхательного центра.
Спирты. Ч.3-2. Номенклатура одноатомных спиртов. Практика.
Алкогольная стадия возбуждения протекает бурно и при медленном поступлении препарата в кровь у отдельных животных, например жвачных, переходит в буйство. Наркоз не имеет такой глубины, как при действии типичных средств для наркоза.
В организме подвергается окислению в две фазы:
1-я с участием алкогольдегидроксидазы и превращением в токсичный уксусный альдегид;
2-я с участием ацетальдегироксидазы окисляющей уксусный альдегид до СО2 и Н2О.
Неизмененный спирт этиловый выделяется легкими, почками и потовыми железами.
Как средство для наркоза алкоголь можно применять в 20 — 33 0 — ной концентрации в/в жвачным, при таком наркотизировании нет обильной секреции бронхиальных желез и тимпании. Для лошадей менее приемлем.
Этанол обладает также противомикробным действием.
При воздействии на микрорганизмы растворами от 50% до 70% концентрации противомикробное действие возрастает, а от 70% до 96% — снижается. Это связано с тем, что образуемые на поверхности микробной клетки альбуминаты будут тем плотнее, чем выше концентрация алкоголя. В абсолютном алкоголе микробная клетка обезвоживается и покрываться плотным альбуминатным “чехлом”, который защищает ее от проникновения вглубь новых порций препарата. 70 %-ный алкоголь дает “рыхлые” альбуминаты, через которые его молекулы беспрепятственно проходят, насыщая микробную клетку и денатурируя ее жизненно важные ферменты.
Местное действие этанола при нанесении на кожу и укутывании этого места материалом (согревающий компресс), алкоголь, испаряясь, раздражает чувствительные нервные окончания с последующей их анестезией, вызывает гиперемию и улучшает обмен веществ здесь и во внутренних органах или глубоких тканях, связанных с рецептивным полем этого участка кожи.
Резорбтивное действие этанола — после всасывания он влияет на теплорегуляцию, повышает теплоотдачу (за счет расширения сосудов кожи, что является следствием угнетения сосудодвигательного центра).
7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химии
Вследствие снижения продукции антидиуретического гормона задней доли гипофиза он оказывает мочегонное действие.
Усиливает секреторную активность слюнных и желудочных желез (это является результатом его психогенного, рефлекторного и прямого действия на железы).
В концентрации выше 40% угнетается секреция НСl и активность пищеварительного сока, железами желудка продуцируется значительное количество слизи.
На функцию кишечника влияет мало.
При длительном применении спирта этилового развивается привыкание и зависимость (психическая и физическая).
Дозы 95 % алкоголя:
наркотические лошадям крупному рог.ск. м. р. с.
внутрь 150-200 150-200 60-80
в/в 80-120 80-100 40-50
внутрь и в/в 70-100 80-100 30-40
пищеварение (в/н) 10-50 10-50 2-10
Выпускают спирт этиловый 95%, 90%, 70%, 40%.
Широко применяется для изготовления настоек, экстрактов, лекарственных форм для наружного применения, как антисептик.
В качестве противошокового средства (учитывая его обезболивающее действие) входит в состав жидкостей:
Сыворотка по Кадыкову для в/в введения.
Состав: камфора 1 г;
спирт этиловый 65-75 мл;
изотонический раствор натрия хлорида до 1,5 л.
Жидкость по Плахотину.
Состав: спирт 200 мл;
гексаметилентетрамин 10 г;
аскорбиновая кислота 2 г;
0,85% раствор натрия хлорида до 2 л.
Внутривенно крупным животным 500 — 2000 мл;
мелкому рогатому скоту — 50 — 200 мл.
Источник: studfile.net
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Спирты
Источник: studarium.ru
Классификация, строение, изомерия и номенклатура спиртов
Спирты (алкоголи) – это углеводороды, строение которых отражается наличием по крайней мере одной гидроксильной группы –ОН, присоединенной к углеводородной цепи. Далее детально рассмотрим какова классификация, строение, изомерия и номенклатура спиртов.
Классификация спиртов
Классификация по строению связанной с ОН – группой углеводородной цепи:
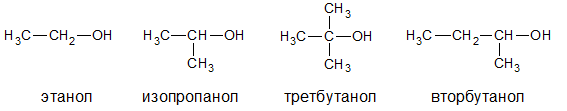
• Предельные спирты. Гидроксильная группа связанна насыщенной углеродной цепью, например, этанол, изопропанол, третбутанол, вторбутанол:

• Непредельные спирты. Гидроксильная группа связанна с углеродной цепью, в составе которой имеется одна или несколько кратных связей, например, аллиловый и пропаргиловый спирты:
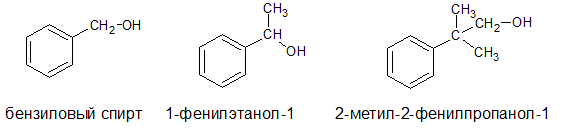
• Ароматические спирты. Группа – CH2OH связанна с ароматической структурой, например, бензиловый спирт, 1-фенилэтанол-1, 2-метил-2-фенилпропанол:
Классификация по количеству ОН – групп в молекуле
• Одноатомные спирты. В молекуле присутствует только одна гидроксильная группа, например, третбутанол, пропинол, бензиловый спирт (структурные формулы представлены выше).

• Многоатомные спирты. В молекуле присутствует более двух гидроксильных групп, например, этиленгликоль (1,2-этандиол), глицерин (1,2,3-пропантриол), пинакон (2,3-диметилбутандиол-2,3):
Многоатомные спирты, в молекуле которых каждая группа – ОН соединена с различными атомами углерода стабильны.
Если две ОН – группы находятся у одного атома углерода, то такие соединения не отличаются стабильностью. В этом случае происходит отщепление молекулы воды и переход в более устойчивый альдегид.
Молекул спиртов, в которых у одного атома углерода находятся одновременно три ОН – группы не существуют.
Классификация спиртов по характеру связанного с гидроксильной группой углеродного атома
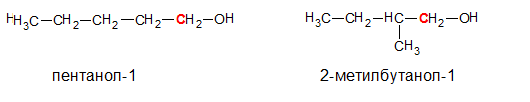
• Первичные. ОН — группа связана с первичным атомом углерода (т.е. связанным еще с одним атомом углерода), например, пентанол-1, 2-метилбутанол-1:
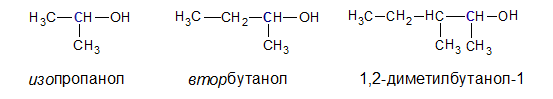
• Вторичные. ОН — группа связана со вторичным атомом углерода (атом углерода связан с двумя другими атомами углерода), например, втор-пропанол, втор-бутанол, 1,2-диметилбутанол-1:
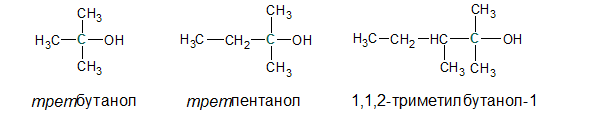
• Третичные. ОН-группа связана с третичным атомом углерода (связанным с тремя другими атомами углерода), например, трет-бутанол, 1,1,2-триметилбутанол-1:
Гидроксильные группы аналогично называют первичной, вторичной и третичной.
Молекулы многоатомных спиртов одновременно могут содержать и первичные и вторичные группы ОН, например, в глицерине две ОН – группы – первичные и одна вторичная.
Общая молекулярная формула спиртов:
• Насыщенные одноатомные спирты — CnH2n+1OH
• Ненасыщенные одноатомные спирты (одна двойная связь) – CnH2n-1OH
• Многоатомные насыщенные спирты — CnH2n+1(OH)k, где k – целое число более 2.
Строение спиртов
В молекуле предельного спирта атомы углерода и кислорода находятся в состоянии sp 3 – гибридизации.
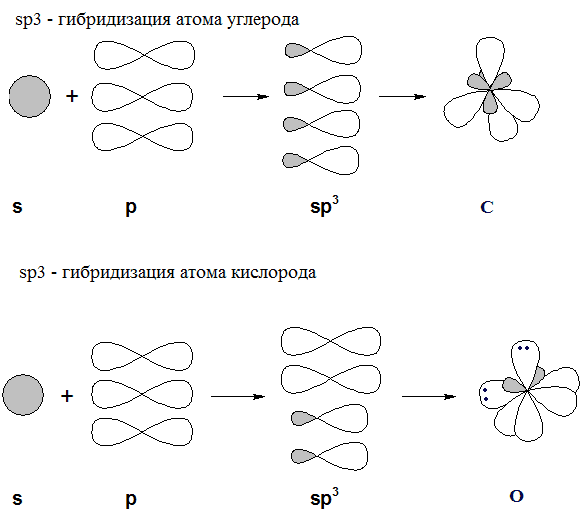
Две гибридные орбитали атома кислорода заняты неподеленными электронными парами, две другие свободны для связывания с другими атомами:
Для примера приведем строение этанола:
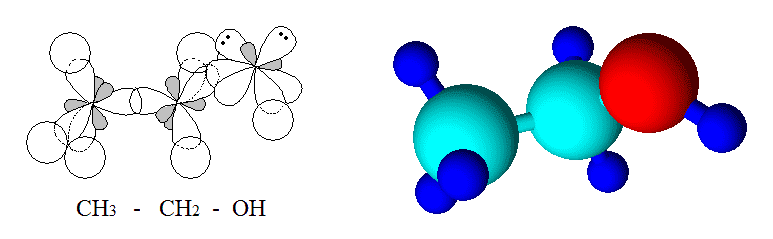
Угол Н-С-Н составляет 109,5°, С-O-H – 108,9° (в молекуле воды угол Н-О-Н равен 104,5°).
Изомерия и номенклатура спиртов
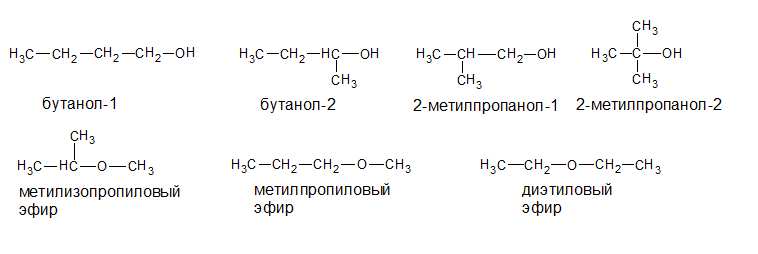
Изомерия спиртов зависит от строения углеродной цепи (изомерия углеродного скелета) и положения —ОН в цепи (функциональная изомерия). Кроме этого, для них характерна межклассовая изомерия (спирты изомерны простым эфирам).
Например, соединение состава С4Н10О имеет следующие изомеры:
Как и другие органические соединения, спирты называют как по правилам рациональной номенклатуры (как замещенные метилового спирта — карбuнола), так и номенклатуры ИЮПАК. Для некоторых из них существуют тривиальные названия.
Наиболее часто используется систематическая номенклатура ИЮПАК. В общем виде, используя правила этой номенклатуры, название можно построить в несколько этапов:
• Назвать самую длинную углеродную цепь, содержащую атом углерода, несущий группу —OH.
• Отбросить окончание -ан от названия соответствующего алкана и добавить суффикс -ол. Если гидроксильных групп несколько, до добавить числительное, показывающее количество ОН-групп (-диол, -триол и т.д.)
• Найти и пронумеровать самую длинную углеродную цепь, начиная с конца, ближайшего к группе —OH.
• При необходимости указать положение группы -OH.
• Назвать заместители, указать их количество и положение.
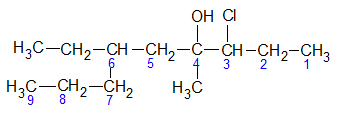
Например, назовем следующие соединения:
Самая длинная цепочка состоит из девяти атомов углерода, поэтому название корня – нона, суффикс -ол.
Группа —ОН находится у четвертого углеродного атома – нонанол — 4.
Также в данном соединении присутствует метильная и этильная группы у четвертого и шестого атомов углерода соответственно, а также атом хлора у третьего атома углерода.
Таким образом, полное название по системе IUPAC – 4-метил-6-этил-3-хлорнонанол-4
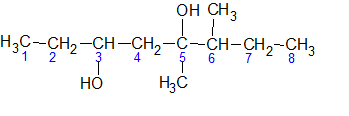
Нумеруем самую длинную цепочку с ближайшего к гидроксильной группе конца.
Она состоит из восьми атомов углерода, поэтому название корня – окта, суффикс -диол, т.к. в соединении содержится две ОН-группы.
Группы —ОН находятся у третьего и пятого углеродных атомов, значит это – октандиол – 3,5.
Также в данном соединении присутствуют две метильные группы у пятого и шестого атомов углерода.
Итак, полное название по систематической номенклатуре IUPAC – 5,6-диметилоктандиол-3,5.
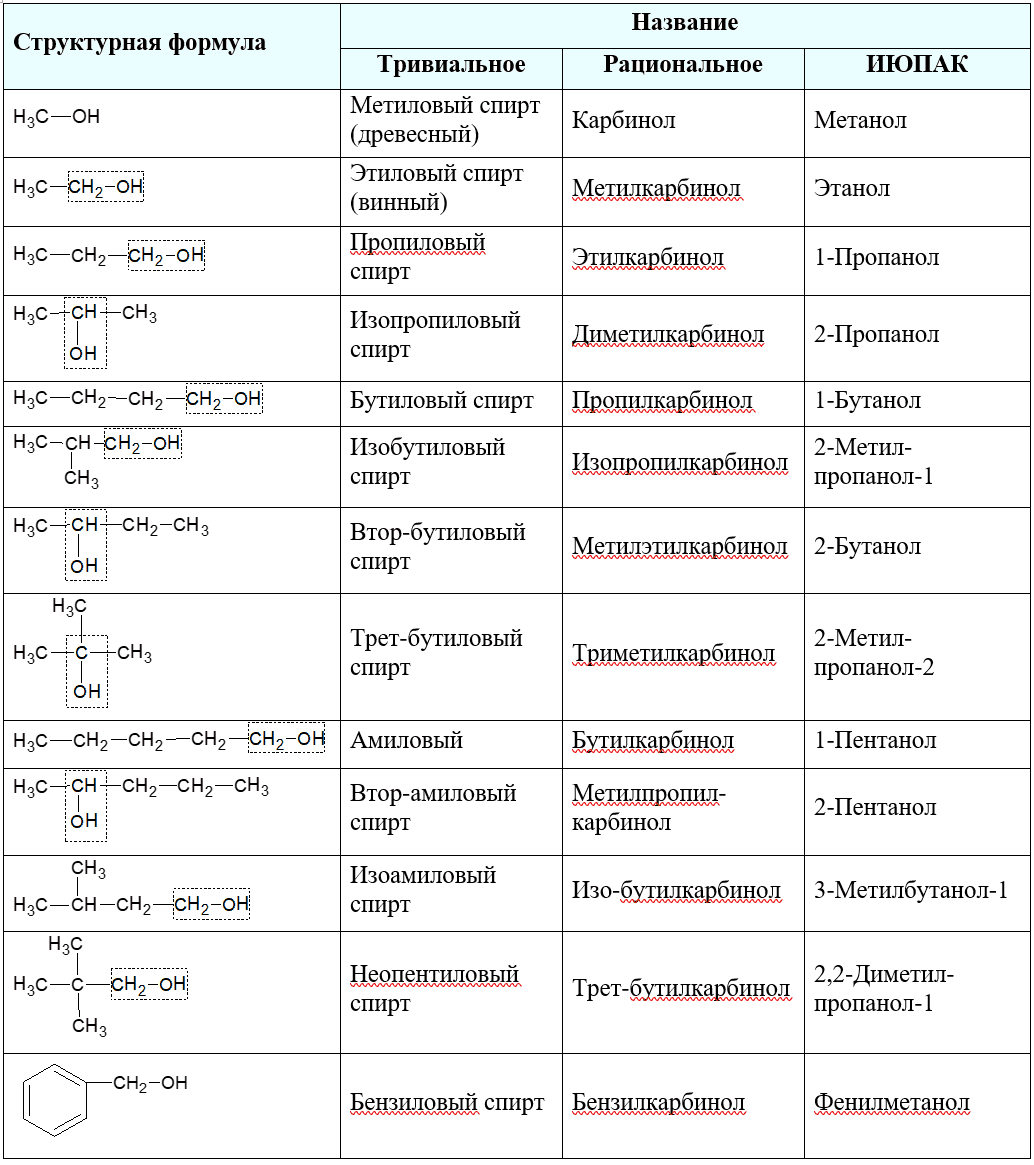
В таблице ниже приведены тривиальные названия некоторых спиртов, названия по рациональной и систематической номенклатурам:
Рубрики
- ОБЩАЯ ХИМИЯ
- Основные понятия и законы химии
- Строение атомов элементов
- Периодический закон Д.И.Менделеева
- Химическая связь и строение молекул
- Основы термодинамики
- Химическая кинетика и равновесие химической реакции
- Растворы
- Окислительно-восстановительные реакции
- Электролиз
- Коррозия металлов
- Комплексные соединения
- Дисперсные системы. Коллоидные растворы
- I группа (щелочные металлы)
- II группа (щелочноземельные металлы)
- III группа (алюминий)
- IV группа (углерод, кремний)
- V группа (азот, фосфор)
- VI группа (кислород, сера)
- VII группа (галогены)
- Краткая история органической химии
- Теория строения А.М. Бутлерова
- Классификация органических соединений
- Изомерия и номенклатура органических соединений
- Типы химических реакций
- Алканы
- Алкены
- Алкины
- Спирты
- Простые эфиры
- Альдегиды, кетоны
- Карбоновые кислоты и сложные эфиры
Источник: zadachi-po-khimii.ru
