Исследователи из Стэнфордского университета сообщили, что они научились управлять молодостью человеческих клеток. Ученые надеются с помощью этого метода остановить заболевания, связанные со старением клеток.
Считается, что основной причиной старения клеток и постепенного выхода их из строя являются ошибки в системе маркировки, которые накапливаются в эпигеноме, который, в свою очередь, управляет активностью и воспроизводством клеток, а также контролирует доступ к генетической информации, сохраняя первичную структуру ДНК.
Команда ученых Стэнфордского университета, под руководством доктора Тапашея Саркара, разработали метод, способный обратить вспять эти ошибки и вернуть клетки в их первоначальное состояние, восстановить энергию клеток и устранить признаки старения.
Суть этого метода в особом перепрограммировании эпигенов до первоначального, эмбрионального состояния. В результате эпигены становятся способными воссоздать необходимое количество молодых, энергетически активных клеток любого вида, например мышцы, печень, почки, кожа.
Эва продукция это компания создающие капсулы которые помогают организму,это не только для иммунитета
перепрограммирование клеток факторами Яманаки
По сути ученые из Стэнфордского университета усовершенствовали технологию, известную как «коктейль Яманаки».
В 2006 году Синья Яманаки из университета Киото создал технологию перепрограммирования клеток методом введения в нее 4 генов: Myc, Oct3/4, Sox2 и Кlf4. За это открытие он получил Нобелевскую премию. А факторы Яманаки стали фундаментальным открытием в биологии.
Ученые Стенфорда выяснили, что клетки, подвергшиеся перепрограммированию на первом уровне восстанавливают энергию эпигенома до уровня, на котором исчезают следы старения, но если продолжить перепрограммирование, то клетка потеряет свою идентичность. Получается, что ученые нашли способ превращать обычные клетки в стволовые.
варианты использования клеток
Для того, чтобы проверить свою теорию ученые получили хрящевые клетки больных остеопорозом и применили к ним коктейль Яманаки. Дальнейшие исследования клеток показало, что они больше не воспроизводят воспалительные факторы, которые провоцируют развитие заболеваний.
К чему приводят генетические эксперименты китайских ученых?
Пожалуйста подпишитесь на мой канал и поставьте
Я буду знать, что вам интересны новости науки и техники со всего света!
Источник: dzen.ru
Коктейль яманаки что это
«Поступай так, чтобы ты всегда относился к человечеству и в своём лице, и в лице всякого другого также как к цели и никогда не относился бы к нему только как к средству». Иммануил Кант
Клетка всемогущая: какие возможности для лечения открывает плюрипотентность
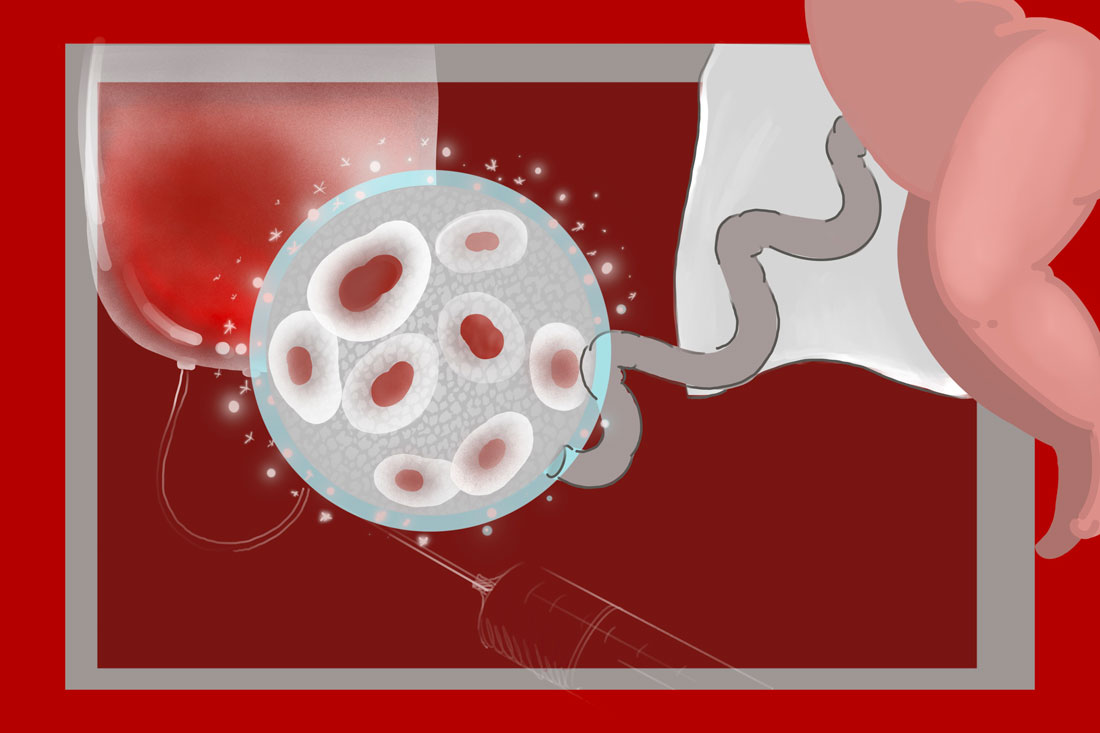
Гемопоэтические стволовые клетки отвечают в организме за кроветворение, давая начало лейкоцитам, тромбоцитам, эритроцитам… А что такое плюрипотентные стволовые клетки и на что они способны, разбиралась Кровь5.
ЗАИКАНИЕ. МЕТОДИКА. СКОБЛИКОВА С. Б. РЕЖИМ МОЛЧАНИЯ
На самой ранней, зародышевой, стадии эмбриональные клетки не имеют конкретной специализации и могут развиться практически в какие угодно. Эта их особенность создает широкие возможности для моделирования того, как развиваются болезни, а следовательно, и разработки более эффективного их лечения.
Сила неопределившихся
Это свойство эмбриональных клеток давать начало клеткам всех типов в организме называется плюрипотентностью. Сохраняется оно недолго, всего лишь одиннадцать дней — с момента оплодотворения яйцеклетки и до имплантации зародыша в стенку матки.
Все это время идет активный процесс самообновления: эмбриональные стволовые клетки (ЭСК) могут бесконечно делиться, производя дочерние, сохраняющие те же свойства клетки-предшественника. Чтобы затем, получив определенный сигнал, выйти из режима самообновления и включить программу, ведущую к дифференцировке в специализированные типы клеток, превратившись уже в мультипотентные, которые размножаются в одном выбранном направлении, чтобы «растить» конкретный орган.
Однако пока эмбриональная стволовая клетка «раздумывает», в какую будет развиваться, она обладает соблазнительным потенциалом для ученых.

Являясь родоначальницей специализированных клеток, она может использоваться для создания гемопоэтических клеток, нейронов, гепатоцитов и кардиомиоцитов, то есть клеток печени и сердца, и др. И далее применяться для изучения и лечения заболеваний, для создания новых лекарств.
Спорные источники
В 1981 году эмбриональные стволовые клетки были впервые выделены из мышиной бластоцисты — части, которая дает начало эмбриону. Человеческие ЭСК были получены значительно позже, только в 1998-м, путем экстракорпорального оплодотворения (ЭКО). Создание линий человеческих ЭСК показало, что они могут неограниченно расти in vitro (в пробирке), сохраняя свой кариотип и плюрипотентность. Их потенциал развития для дифференцировки во все типы клеток организма был подтвержден несколькими анализами in vitro и in vivo (на живой ткани).
Но встала серьезная этическая проблема. Ведь стволовые клетки не просто обладают плюрипотентным свойством на эмбриональном этапе. По сути одиннадцатидневный эмбрион — не что иное, как скопление этих самых клеток. Таким образом, их можно получить, лишь разрушив его. Сторонники таких исследований упирали на то, что для выделения плюрипотентных клеток используются эмбрионы, полученные с помощью ЭКО и никем не востребованные, которые все равно утилизируют.
Разрешить биоэтическую дилемму попытались ученые Гарвардской медицинской школы, предложив получать ЭСК методом химеризации. Для этого соматические клетки человеческого плода соединили с коровьей яйцеклеткой, из которой предварительно удалили ядро (пронуклеус). Таким образом были получены гибридные бластоцисты, а уже из них — эмбриональные стволовые клетки.
С одной стороны, данный метод позволял избежать использования человеческого эмбриона и связанного с этим биоэтического конфликта. С другой — порождал новые вопросы, ведь это был межвидовой зародыш.
Неизвестно, какая у него генетика, насколько он жизнеспособный, а риск передачи таким образом зоонозных инфекций (от животных человеку) достаточно велик.

Несмотря на эти риски и жаркие научные дискуссии об этичности подобных исследований, в 2000 году Австралия, Япония и Великобритания отменили мораторий на такие эксперименты и разрешили работу над созданием межвидовых гибридов.
Точку в дискуссии обозначили японские ученые.
Коктейль Яманаки
В 2012 году Нобелевская премия по физиологии и медицине была вручена Джону Бертрану Гёрдону, профессору Кембриджского университета и руководителю Института Гердона, и Синъе Яманаке, профессору Университета Киото и Института Гладстона. Их наградили за открытие возможности перепрограммирования соматических клеток в плюрипотентные.
Справедливости ради надо отметить, что первые опыты по перепрограммированию соматических клеток в плюрипотентные путем переноса ядра были проведены гораздо раньше, еще в начале 1960-х, когда будущий нобелевский лауреат Яманака только родился. Однако лишь спустя почти четыре десятилетия, в 2006 году, он вместе с коллегой Кацутоси Такахаси сумел идентифицировать гены, которые, собственно, и запускали процесс репрограммирования фибробластов кожи мыши в плюрипотентные клетки.
«Коктейль Яманаки» — такое название получила совокупность четырех генов Oct4, Sox2, Klf4 и c-Myc (OSKM), которые достаточно ввести в любые взрослые клетки, чтобы спустя месяц они ничем бы не отличались от эмбриональных, то есть стали бы плюрипотентными.
Потом подобный эксперимент был проведен с использованием фибробластов человека. Перепрограммированные клетки получили название «индуцированные плюрипотентные стволовые клетки» (иПСК).
Многочисленные эксперименты подтвердили, что плюрипотентность достигается скоординированными действиями этих генов с множественными сигнальными путями, дающими ответ на определенные условия окружающей среды. У ЭСК такое состояние сохраняется те самые одиннадцать дней до момента гаструляции — сложного процесса морфогенетических изменений, при котором начинается дифференцировка клеток, дающих начало различным тканям и органам. На этом этапе уровни транскрипционных факторов снижаются, и клетки теряют свои плюрипотентные свойства. У иПСК «срок действия» плюрипотентности неограничен.
Получая Нобелевскую премию, Яманака призвал ученых отказаться от использования эмбриональных клеток. Ведь плюрипотентные клетки, полученные искусственным путем, имеют те же характеристики, что и эмбриональные, но при этом не провоцируют биоэтический конфликт.
Уравнение с неизвестными
Впрочем, дальнейшие исследования по перепрограммированию мышиных и человеческих стволовых клеток показали, что не все так просто с ними. Эксперименты подтверждали, что данная методология применима практически для всех соматических клеток, а иПСК потенциально могут обеспечить получение неограниченного количества аутологичных клеток для разных нужд медицины.
При этом эффективность перепрограммирования пока еще крайне низка: плюрипотентными становятся менее 1% соматических клеток.
Не определен пока как долгосрочный эффект, так и риски их применения. Все же взрослые соматические клетки, из которых получают плюрипотентные, за время жизни накапливают в своих геномах различные изменения. Как они отразятся на перепрограммируемых, вопрос открытый. Высказываются опасения, что перепрограммирование может активировать развитие опухолей.
Не все однозначно и с иммунной совместимостью с клетками пациента. Ряд исследований показал, что клетки, полученные из индуцированных плюрипотентных клеток, могут вызывать отторжение при трансплантации. Нельзя исключать и риск присутствия клеток нежелательного типа в клеточном трансплантате.
В общем пока применение иПСК — уравнение со многими неизвестными, которое ученым еще только предстоит решить.
Потенциал без границ?
Вместе с тем потенциал плюрипотентных клеток огромен. Речь не только про их способность дифференцироваться в определенные типы клеток, но и про клиническое применение. В первую очередь их использование имеет большие перспективы в регенеративной медицине.
Сейчас сразу несколько научных институтов в США и Японии ведут работы по дифференцировке ПСК в пигментный эпителий сетчатки. Его повреждение является проявлением многих дегенеративных заболеваний сетчатки глаза, в том числе возрастной макулярной дегенерации. Это прогрессирующее глазное заболевание, которое приводит к снижению остроты зрения за счет поражения центрального отдела сетчатки глаза — макулы. Применение иПСК позволит замедлить развитие патологии и даже вернуть зрение. Кровь5 рассказывала о таких экспериментах.
Клетки, полученные из иПСК, также используются в клинических испытаниях иммунотерапии рака для лечения опухолей на поздних стадиях.
Несколько лет назад было одобрено клиническое исследование кардиомиоцитов, полученных из иПСК, для лечения сердечных заболеваний.
Помимо использования в регенеративной медицине для лечения поврежденных тканей с помощью клеточно-заместительной терапии иПСК используют для моделирования заболеваний, например нейродегенеративных. Чтобы понять, что происходит в организме при болезни Альцгеймера или Паркинсона, нужно исследовать нейроны. Но от пациента их получить весьма затруднительно. Зато их можно вырастить, причем уже с патологией.
Для этого надо получить клетки кожи у пациента с соответствующим заболеванием. Эти клетки подвергают репрограммированию с помощью того самого «коктейля Яманаки», в результате чего получают плюрипотентные клетки. Затем их дифференцируют в специализированные, в данном случае в нейронные, и получают необходимый материал для исследования.
Первое клиническое испытание по лечению болезни Паркинсона с использованием нейронов, полученных из иПСК, было проведено в 2018 году в Университете Киото.
Еще одно перспективное направление — возможность редактировать геном иПСК и возвращать пациенту уже исправленные клетки. Первые шаги в этой области уже ведутся: исследователи попытались исправить мутацию, отвечающую за серповидноклеточную анемию. С помощью технологии геномного редактирования они изменяли стволовые клетки костного мозга и обратно вводили отредактированные. Гипотетически вместо стволовых клеток можно использовать индуцированные плюрипотентные.
Перспективы применения иПСК, в общем, захватывающие.
Источник: blood5.ru
Биотехнологии будущего. Что почитать на выходных о старении
Вы когда-нибудь задумывались почему с возрастом мы стареем? Почему уже в 30 мы выглядим не так как в 20? Для нас это является настолько естественным, что мы не представляем как может быть иначе. Однако рано или поздно каждый об этом задумывается. Сегодня процесс старения мало изучен.
Однако каждый год в области биотехнологий появляются все больше исследований, которые проливают свет на внутренние механизмы нашего организма.
Перед выпуском статьи у меня были сомнения стоит ли ее публиковать. Сколько я не пытался упросить информацию — статья все равно получилась техническая. Однако среди своих знакомых я вижу к этой теме растущий интерес, поэтому я решил что информация, которую я систематизировал для себя, будет полезна и другим.
Я систематизировал все в краткий список Google-запросов по которым можно за пару дней получить базовые знания на тему старения. Поэтому если вы решите изучить эту область, то вам нужно последовательно набирать из статьи поисковые запросы, которые выделены жирным шрифтом, и читать предложенный в поиске материал. Это не нужно пытаться сделать за один день, вполне нормально, если на изучение материала уйдет пара месяцев. Но повторюсь — это всего лишь базовые знания. Но если вы внимательно все изучите и осознаете — это перевернет вашу картину мировоззрения.
Общие вопросы, ищем:
- Геронтология — наука изучающая аспекты старения. Просто общая информация.
- Пренебрежимое старение — полное решение проблемы возрастного старения заключается в достижении состояния пренебрежимого старения.
- Строение клетки — придется освежить школьные знания биологии. Нужно будет вспомнить, что организм состоит из клеток, что в них есть ДНК, РНК, митохондрии и т.п.
Внешнее старение, ищем:
- Морщины, пигментация — нужно понять какие есть внешние признаки проявления старения.
- Внеклеточный матрикс — строение кожи похоже на слоеный пирог. Сверху идет внешний слой, который удерживается внутренним слоем из эластина, коллагена.
- Эластин — белок, который имеет свойство хорошо растягиваться.
- Коллаген — белок, который имеет свойство прочности и эластичности. По структуре похож на спираль.
- Тургор кожи — упругость кожи, способность ее принимать прежнюю форму после растяжения. Упругость кожи обеспечивается коллагеном и эластином, которые со временем теряют свою функцию. С возрастом упругость кожи снижается, что является причиной возникновения морщин и опусканием линий лица вниз.
- Коллаген в коже (смотрим в Google Image) — можно найти классные картинки на которых будет видно каким образом эти два белка не дают кожи растягиваться под действием гравитации. Образно говоря это похоже на матрас с пружинками). Вы можете надавить на край матраса или растянуть его, он моментально вернётся в исходное состояние. Так в норме выглядит состояние кожи до 25-30 лет.
Механизмы обновления клеток, ищем:
- Время жизни клеток — нужно понимать, что организм постоянно нуждается в обновлении своих клеток. Время жизни клеток печени от 150 до 500 дней, кожи 2-4 недели. Обновление происходит путем деления и периодическим отмиранием старых клеток.
- Апоптоз — естественный процесс самоуничтожения клеток. Ежедневно в нашем организме погибает более 50 млрд клеток, что по массе может составлять массу всего нашего тела. Термин появился в 1971 году.
- Катаболизм коллагена — постоянному обновлению нуждаются и белки коллаген и эластин, которые отвечают за упругость кожи. Период полураспада коллагена составляет около месяца. Поэтому в организме предусмотрены механизмы постоянного разрушения и синтеза коллагена и других белков, которые обеспечивают функции кожи. Нарушение процесса разрушения и синтеза коллагена, приводит к снижению упругости кожи.
- Фибробласты — клетки кожи, которые производят синтез белков коллагена и эластина. Фибробласты также как и другие клетки организма имеют способность к обновлению.
Механизмы ограничения деления клеток, ищем:
- Предел Хейфлика — любая клетка организма от момента рождения может поделиться в среднем не более 50 раз. Открыто эксперементально в 1961 году Леонардом Хейфликом. Долгое времени эффект не имел научного объяснения.
- Теломеры — концевые участки ДНК. Информации не несут, образно можно представить в качестве защитных колпачков на концах цепочек ДНК. В 1971 ученым Алексеем Оловником выдвинуто объяснение Пределу Хейфлика. Он предположил, что в процессе деления клеток на концах ДНК каждый раз теряется информация. В свою очередь новая клетка порождает дочернюю клетку с еще более короткой ДНК. Этот процесс повторяется до тех пор пока в результате деления не произойдет сбой и нарушение работы клетки.
- Телемераза — фермент, который позволяет наращивать концевые участки ДНК и преодолевать предел Хейфлика. В норме присутствует только в половых и стволовых клетках, в других клетках отсутствует. Механизм синтеза фермента включается в процессе появления раковых клеток, что позволяет подобным клеткам делиться вечно. Присутствие теломеразы в клетках может является одним из способов выявления раковых клеток и их уничтожения (Google нуклеотид 5-FdUTP).
Механизмы естественного старения клеток, ищем:
- Метилирование ДНК — механизм, который позволяет отключать определенные участки ДНК. У человека метилировано (отключено) около 1% ДНК.
- Эпигенетический дрейф — изменение профиля метилирования ДНК в течение жизни организма. Присутствует у каждого человека. В результате часть генов, которые были раньше отключены — включаются, а другая часть — включается.
- Часы Хорвата — математическая модель, которая позволяет по профилю метилирования вашей ДНК определить возраст организма с точностью в 3 года. Открыта в 2013 году.
- Транспозоны — участки ДНК, которые способны перемещаться и копироваться в пределах генома (совокупность ДНК).
- Ретротранспозоны — участки ДНК, являются подклассом транспозонов. Могут самопроизводиться. Из них на 42% состоит геном человека. До 90% метилированного генома человека приходится на ретротранспозоны.
- Alu-повтор — ретротранспозон, составляет 11% нашей ДНК. Может приводить к мутациям и межхромосомным перегруппировкам. Alu-повторы в клетках метилированы. За время эволюции активность Alu снизилась. Сейчас новая вставка элемента осуществляется примерно раз в 20 поколений.
- ДНК-метилтрансфераза — ферменты, которые отвечают за процесс метилирования ДНК. DNMT-3 прикрепляет метильные группы к ДНК.
- Метилирование защитный механизм — повышенные уровни метилирования ДНК в большей степени присущи некодирующим участкам ДНК. Некоторые вирусы могут блокироваться посредством метилирования.
- Фолатный цикл метилирование — в этом цикле происходит перенос метильных групп. В фолатном цикле может произойти сбой из-за дефицита метионина, фолиевой кислоты и других витаминов группы В. Возникает дефицит основного донора метильных групп. Для цикла необходимы витамины B9 (фолиевая кислота), В6 и В12.
- Снижение калорий метилирование ДНК — читаем про связь между калорийностью еды и нарушениями в метилировании ДНК.
Механизмы работы антиоксидантов, ищем:
- Активные формы кислорода — образуются в клетках митохондриями во время переваривания клеткой кислорода. Около 98% кислорода митохондриями восстанавливается до воды, остальные 2% преобразуются в опасные формы кислорода. За счет наличия неспаренного электрона подобная молекула готова моментально вступить в реакцию с любым соединением.
- SkQ — класс антиоксидантов, которые работают на уровне митохондрий.
- АФК вирусы — выясняем, что кроме вреда АФК несут и пользу. Участвуют в антивирусной защите организма.
Другая информация по теме, ищем:
- p66Shc — белок, редкий ген старения. Оказывает влияние на уровень внутреклеточного АФК (активная форма кислорода) и регуляцию апоптоза (самоуничтожение клетки).
- p66Shc нокаут — отключение (репрессия) гена p66Shc повышает устойчивость организма к окислительным процессам, но повышает риск возникновения опухолей.
- hTERT экспрессия — приводит к увеличению активности теломеразы и длины теломер. РНК-терапия hTERT продлила срок жизни фибробластов и сопровождалось признаками омоложения фибробластов (исследование 2017 год).
- CRISPR/cas9 — технология редактирования генома.
По теме стволовых клеток, ищем:
- Стволовые клетки — клетки организма, которые еще не определились кем они будут в организме. Являются родоначальниками всех клеток организма. Под воздействием внешних факторов могут формироваться как в ткани костей, так и в ткани клеток кожи.
- Банк стволовых клеток — технология, которая позволяет консервировать стволовые клетки.
- Индуцированные стволовые клетки — технология, которая позволяет обычные клетки (например, клетки кожи) превращать обратно в стволовые. При преобразовании обычных клеток обратно в стволовые их профиль метилирования восстанавливается в исходное состояние, а длина теломер восстанавливается. В дальнейшем их можно преобразовать обратно в те же клетки кожи или в костную ткань. В сыром виде ИСК не используются, так как неизвестно в какие клетки они обратную преобразуются в организме.
- Коктейль Яманаки — коктейль сигнальных белков, который позволяет осуществлять преобразование обычной клетки в индуцированную стволовую клетку (работы 2006 года). Открыт японским ученым Синья Яманака, за что в 2012 году стал лауреатом Нобелевской премии.
- Коктейль Яманаки бинарность — процесс преобразования обычной клетки в стволовую постепенный, возможен откат эпигенетических маркеров (например, профиля метилирования ДНК) клетки без изменения ее типа. Исследования стартовали в 2017 году.
Попробуем все систематизировать
В первой части можно найти основные факторы, которые влияют на определение внешнего возраста человека. Упругость кожи является основным фактором нарушение которого приводит к появлению морщин и снижений линий лица. Также мы определяем возраст человека по пигментации кожи. Можно заметить что цвет нашей кожи с возрастом становится менее равномерный.
Если процесс возникновения пигментации до конца не изучен, то появление морщин связано с нарушением регенерации белков эластина и коллагена. Нарушение процесса обновления коллагена и эластина связано с снижению активностью клеток фибробластов. Снижение активности клеток фибробластов связано с достижением клеток предела Хейфлика. Что обусловлено сокращением длины теломер при делении клетки.
В следующей части описан второй фактор возрастного старения — изменение с возрастом профиля метилирования. Что вероятно является одним из основных механизмом, который обуславливает возрастные изменения после 45 лет и оказывает существенное влияние на организм человека. Смещение профиля метилирования опасно тем, что цепочки Alu-повторов, которые в основном отключены, могут активироваться, что в свою очередь может приводить к мутациям в ДНК и саморазрушениям клеток.
Что дальше?
Первой технологией для скрытия возрастных изменений была подтяжка контуров лица с помощью нитей, но технология скрывает только причину. В дальнейшем появилась технология инъекций коллагена и гиалуроновой кислоты. Коллаген выполняет функцию эластичности, гиалуроновая кислота связывает воду. Недавно появилась технология инъекций клеток фибробластов. Однако подобная технология имеет минус в том, что стоимость курса может достигать 500 000 руб и результат сходит на нет в течение года (см. среднее время жизни фибробластов).
Пока медленно начинают появляются технологии, которые позволяют преодолеть предел Хейфлика. Это вероятно позволило бы продлить время жизни фибробластов и сделать отсрочку возрастных изменений на 15-20 лет. В 2015 году Элизабет Пэрриш, директор фармацевтической компании, стала первым человеком в мире, который решился на модификацию своих генов с использованием AAV-вируса. По словам самой Элизабет Пэрриш она стала чувствовать себя моложе и лучше. С 2016 по 2018 год ее теломеры увеличились с 7,33 тыс. до 8,12 тыс. пар оснований, что эквивалентно омоложению на 20 лет.
Если вы хотите без генной терапии добиться здоровья вашего тела, то выполнение гимнастики и правильное питание — это номер один. В ходе наших исследований мы доказали, что человек может изменить, выключить или включить некоторые гены просто ведя здоровый образ жизни.
Elizabeth Parrish, CEO of BioViva
Однако пока что остается не решенным один из возможно ключевых механизмов старения — смещение профиля метилирования ДНК. Есть исследования согласно которым снижение калорийности еды приводит к снижению скорости смещения профиля. Также важно иметь сбалансированное питание, чтобы предотвратить дефицит метионина (содержится в молоке и сырах), фолиевой кислоты и витаминов группы В. Также возможно прием антиоксидантов может снизить скорость смещения профиля. В этом плане интересным проектом является разработка антиоксиданта SkQ, который проникает в митохондрии клеток и гасит активность АФК.
Технологии борьбы с возрастными изменениям никогда не сделают жизнь человека вечной — это утопия. В перспективе это поднимет границу среднего возраста жизни, но математически она всегда будет конечна. Просто люди будущего будут проживать возможно чуть более длинную, но без возрастных изменений жизнь.
В конце статьи хочу попросить вас проголосовать: стоит или нет публиковать подобные сложные статьи на VC?
Источник: vc.ru
